Dioksolan
Bu məqaləni vikiləşdirmək lazımdır. |
Dioksolan – oksigen atomunda 2 körpüsü olan beş üzvlü heterotsiklik üzvi birləşmələr sinfinə aiddir. Oksigen atomunun vəziyyətindən asılı olaraq dioksolan 1,2 — və 1,3 — olmaqla bir-birindən fərqlənirlər.
| Dioksolan | |
|---|---|
 | |
 | |
| Ümumi | |
| Sistematik adı | 1,3-dioksolan |
| Kimyəvi formulu | C3H6O2 |
| Molyar kütlə | 74.08 q/mol |
| Fiziki xassələri | |
| Sıxlıq | 1.06 q/sm³ |
| Termik xüsusiyyətlər | |
| Ərimə nöqtəsi | -95 °S |
| Qaynama nöqtəsi | 75 °S |
| Təsnifatı | |
| CAS-da qeyd. nöm. | 646-06-0 |
| PubChem | 12586 |
| ChEBI | 87597 |
| ChemSpider | 12066 |
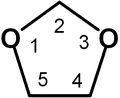
1,2-Dioksolan
redaktə1,2-dioksolan tsiklik peroksidlərə aid olub, qeyri stabildir. 1,2-dioksolan 350 C-ə qədər davamlıdır. Onun törəmələri isə qızdırıldıqda və şüalandıqda asan parçalanır [1]. Onları aşağıdakı sxem üzrə alırlar :
1,2-dioksolan prostaqlandinlərin endoperoksidlərinin biosintezində aralıq məhsuldur.
1,3-Dioksolan
redaktəKimyəvi xassələri
redaktə1,3-dioksolan suda asan həll olur, yod ilə kompleks əmələ gətirir, bromla 2 — brometilformiat əmələ gətirməklə reaksiyaya girir. Xlorla reaksiyasında 2 — və 4 — vəziyyətinə malik olan qarışıq alınır.
Tətbiqi
redaktə- 1,3-dioksolanlara formaldehid və etilenqlikolun tsiklik asetalları kimi baxmaq olar, 1,3-dioksolanın 2-ci vəziyyətdə əvəzlənməsində isə onlara başqa aldehid və ketonların asetalları kimi baxmaq olar. Əsasların və neytral mühitin təsirinə qarşı davamlı olduğuna görə 1,3-dioksolanlar aldehid və ketonları [2] və ya 1,2-diolları[1] mühafizə edir.
-
1,2-diolların mühafizəsi
- Piylər, yağlar və liflərdə ekstragent kimi istifadə olunur.
- Boyaq və sellüloz efirlərində aşağı temperaturda qaynayan həlledici kimi istifadə edilir.
- Reagentlərin məhlulunu orto efirlərin iştirakında qarışdırdıqda bu qarışıqdan suuducu vasitə kimi istifadə edilir[2].
Sintez üsulları
redaktə- 1,3-dioksolanı fosfat turşusunun iştirakı ilə formalin və etilenqlikolu qaynatmaqla alırlar [5].
- SnCl4 iştirakı ilə etilenoksidin ketonlar və ya aldehidlərlə reaksiyası aşağıdakı sxem üzrə gedir :
Mənbə
redaktə- Химическая энциклопедия Т2. — М.: Сов. Энциклопедия, 1990. — С. 74.
- Дж. МакОми. Защитные группы в органической химии. — М.: Мир, 1976. — С. 305–307.
- W. Theilheimer. Synthetic Methods of Organic Chemistry. Interscience Publ. Inc., V 13, 1959, p. 34.
- TETRAHEDRON, 1983, 39, N 6, 991–997.
- И. Губен. Методы органической химии, том 3 выпуск 1. — М.-Л.: ОНТИ, 1934.
- J. AMER. CHEM. SOC., 1982, 104, N 3, 853–855.
- J. CHEM. RES. SYNOP., 1980, NO 18, 95 (M 1163–1173)
