Kalium xlorat
Kalium xlorat — (Bertol duzu[1] , kalium perklorat) — perklor turşusunun kalium duzu.
| Kalium xlorat | |
|---|---|
 | |
 | |
 | |
| Ümumi | |
| Sistematik adı | Kalium xlorat |
| Ənənəvi adı | Bertol duzu |
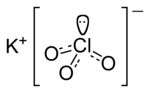
| Kimyəvi formulu | KClO3 |
| Molyar kütlə | 122.55 q/mol |
| Fiziki xassələri | |
| Aqreqat halı (n.ş.) | rəngsiz kristallar |
| Sıxlıq | 2,32 q/sm³ |
| Termik xüsusiyyətlər | |
| Ərimə nöqtəsi | ~ 400 °S |
| Əmələgəlmə entalpiyası (n.ş.) | -391,204 kc/mol kC/mol |
| Kimyəvi xassələri | |
| Suda həllolma | 7,3 (20°C); 56,2 (100°C); 61,5 (104,2°C) q/100 ml |
| suda 0°C-də maddəsində həllolma | 3,25 q/100 ml |
| suda 20°C -də maddəsində həllolma | 7,3 q/100 ml |
| suda 100° C-də maddəsində həllolma | 56,2 q/100 ml |
| Təsnifatı | |
| CAS-da qeyd. nöm. | 3811-04-9 |
| PubChem | 6426889 |
| EINECS-də qeyd. nöm. | 223-289-7 |
| SMILES | 3811-04-9 |
| RTECS | FO0350000 |
| BMT nömrəsi | 1485 |
| ChemSpider | 18512 |
| Toksikologiya | |
| Zəhərliliyi | |
Tarixi
redaktəƏvvəlcə Klod Lui Bertolle ( Bertol duzu buradan adlanır) tərəfindən 1786-cı ildə xlorun kalium hidroksidinin isti bir konsentrasiyalı məhlulu ilə keçməsi zamanı əldə edildi:
Alınması
redaktəÜmumiyyətlə xloratın sənaye istehsalı (və xüsusən kalium xloratı) hipokloritlərin nisbi reaksiyasına əsaslanır və bu da öz növbəsində xlorun qələvi məhlulu ilə qarşılıqlı təsiri nəticəsində əldə edilir:
Prosesin texnoloji dizaynı fərqli ola bilər: ən yüksək tonnajlı məhsul kalsium hipoklorit olduğundan (ağartmanın bir hissəsidir), ən çox yayılmış proses nisbətən az həllolma qabiliyyətinə görə ana liköründən kristallaşan kalsium xlorat (istilik yolu ilə kalsium hipokloritdən əldə edilir) ilə kalium xlorid arasındakı mübadilə reaksiyasındadır.
Kalium xloratı, kalium xloridinin diafraqma olmayan elektrolizi vəziyyətində dəyişdirilmiş Bertoll üsulu ilə alınır, elektroliz zamanı əmələ gələn xlor kalium hipokloritini yaratmaq üçün kalium hidroksidi ilə yerində (təcrid olunmuş anda "yerində") qarşılıqlı təsir göstərir,bu da kalium xlorat və orijinal kalium xlorid nisbətini artırır. Qrafit anodlarından istifadə edərkən daha əlverişli bir üsul, natrium xloratın çıxarılması üçün sodium xloridin elektrolizi və kalium xloru ilə mübadilə reaksiyasıdır. Bu, anod çamurundan natrium xloratın bir həllini təmizləməyinizə imkan verir, bu, kalium xloratından qat-qat çox həllolma qabiliyyətinə malikdir və beləliklə süzülmək üçün daha əlverişlidir.
Kimyəvi xassələri
redaktə- ~ 400 ° C temperaturda kalium perxloratın aralıq meydana gəlməsi ilə oksigen buraxılmaqla parçalanır:
- Katalizatorların iştirakı ilə (MnO2, Fe2O3, CuO və s.) parçalanma istiliyi əhəmiyyətli dərəcədə azalır (~ 200 ° C-ə qədər).
- Ammonium xloratın meydana gəlməsi ilə su-spirtli bir həllində ammonium sulfat ilə reaksiya verir:
Tətbiqi
redaktəKalium xlorat katalizator iştrakı ilə qızdırıldıqda maddənin bir qismi parçalanır. Bu zaman normal şəraitə hesablanmaqla 6,72 litr qaz və 16 q bərk qalıq əmələ gəlir. Qalığa 170 q 30%-li gümüş nitrat məhlulu əlavə olunur. Son məhlulda gümüş nitratın kütlə payını hesablayın.
Nəzərə alın ki, kalium xlorat KClO3və gümüş xlorat AgClO3 suda həll olur[2].
Partlayıcı maddələr
redaktəKalium xloratın azaldıcı maddələrlə qarışıqları (fosfor, kükürd, alüminium, üzvi birləşmələr) partlayıcı və sürtünmə və şoka həssasdır,bromatlar və ammonium duzlarının iştirakı ilə həssaslıq artır.
Bertol tuzu ilə birləşmələrin yüksək həssaslığı səbəbindən sənaye və hərbi partlayıcı maddələrin istehsalı üçün praktik olaraq istifadə edilmir.
Bəzən pirotexnikada rəngli alov kompozisiyaları üçün xlor mənbəyi kimi,kibrit başının yanan materialının bir hissəsidir və nadir hallarda baş verən partlayıcı kimi istifadə olunur.
Tibbdə
redaktəBir müddət kalium xlorat məhlulları zəif antiseptik, qarqara üçün xarici dərman kimi istifadə edilmişdir.
Oksigenin alınmasında
redaktəXX əsrin əvvəllərində laboratoriyada oksigen istehsalı üçün istifadə edilmişdir.Lakin az olması səbəbindən istifadə etməyi dayandırdılar.
Xlor qazının alınmasında
redaktəLaboratoriya şəraitində xlor qazının çıxarılması üçün kükürd turşusu əlavə edildikdə kalium xloratın oksalik turşu ilə azaldılması reaksiyasından istifadə olunur:
Kalium xloratı sulfat turşusunun iştirakı olmadan oksalik turşu ilə reaksiya göstərə bilər, lakin bu reaksiya xlor dioksidinin hazırlanması üçün istifadə edilmir:
Zəhərliliyi
redaktəZəhərlidir. Kalium xloratın öldürücü dozası 1 q / kq təşkil edir[3].
Həmçinin bax
redaktəİstinadlar
redaktə- ↑ // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.). СПб.. 1890–1907.
- ↑ "Həll edilməsi tələb olunan kimya məsələsi - №10" (az.). 2020-01-14 tarixində arxivləşdirilib. İstifadə tarixi: 2020-01-14.
- ↑ Новый справочник химика и технолога. Радиоактивные вещества. Вредные вещества. Гигиенические нормативы. СПб.: АНО НПО «Профессионал». Редкол.: Москвин А. В. и др. 2004.
Ədəbiyyat
redaktəВуколов, Семён Петрович Менделеев, Дмитрий Иванович. // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.). СПб.. 1890–1907.
